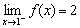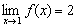Pengertian tentang limit dapat diperoleh dengan melihat contoh berikut ini.
Contoh: Perhatikan fungsi
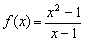
untuk nilai x yang mendekati 1
Gambar grafiknya:

Dari gambar dan tabel dapat disimpulkan:
→ Jika x mendekati 1 dari kiri, maka nilai f(x) mendekati 2
→ Jika x mendekati 1 dari kanan, maka nilai f(x) mendekati 2
→ Jadi, jika x mendekati 1, maka nilai f(x) mendekati 2
Teorema:

Jika limit kiri dan limit kanan tidak sama, maka nilai limitnya tidak ada
Hasil limit tidak boleh bentuk tak tentu:

Sifat-Sifat Limit
Contoh:
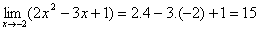
2. Pemfaktoran (biasanya untuk bentuk 0/0)
Contoh:
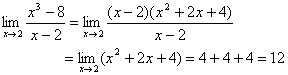
Ingat:
3. Dikali sekawan (jika ada bentuk akar)
Contoh:

4. Untuk limit tak terhingga:
→ Jika bentuknya sudah pecahan: dibagi pangkat tertinggi
→ Jika bentuknya belum pecahan: dikali sekawan, baru dibagi pangkat tertinggi
Sifat operasi dengan ∞:

Contoh:

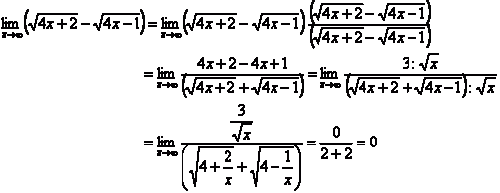
Cara cepat!
→ Untuk bentuk pecahan:
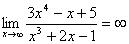
Contoh 2:

Contoh 3:
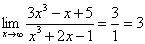
→ Untuk bentuk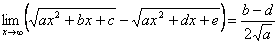
Contoh:
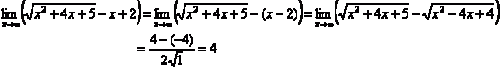
5. Limit trigonometri:

Untuk cosinus:
1 – cos ax = 2 sin2 ½ ax (dari rumus cos 2x)
cos ax – 1 = –2 sin2 ½ ax (dari rumus cos 2x)
1 – cos2ax = sin2ax (dari sin2x + cos2x = 1)
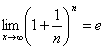
e = 2,718281828…
Rumus-rumus pengembangannya:

1. f(a) ada (dapat dihitung/real)
2.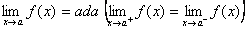
3.
Ilustrasi:
Contoh: Perhatikan fungsi
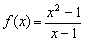
untuk nilai x yang mendekati 1
| x | 0 | 0,9 | 0,95 | 0,98 | … | 1,0001 | 1,0005 | 1,05 | 1,1 |
| f(x) | 1 | 1,9 | 1,95 | 1,98 | … | 2,0001 | 2,0005 | 2,05 | 2,1 |

Dari gambar dan tabel dapat disimpulkan:
→ Jika x mendekati 1 dari kiri, maka nilai f(x) mendekati 2
→ Jika x mendekati 1 dari kanan, maka nilai f(x) mendekati 2
→ Jadi, jika x mendekati 1, maka nilai f(x) mendekati 2
Teorema:

Jika limit kiri dan limit kanan tidak sama, maka nilai limitnya tidak ada
Hasil limit tidak boleh bentuk tak tentu:

Sifat-Sifat Limit
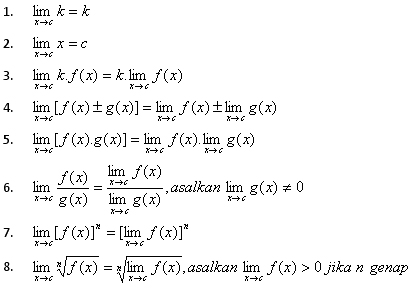
Cara Penyelesaian Limit dengan Perhitungan:
1. Substitusi langsungContoh:
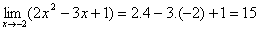
2. Pemfaktoran (biasanya untuk bentuk 0/0)
Contoh:
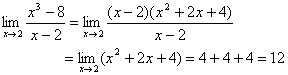
Ingat:
(a2 – b2) = (a – b)(a + b)
(a3 + b3) = (a + b)(a2 – ab + b2)
(a3 – b3) = (a – b)(a2 + ab + b2)
Contoh:
4. Untuk limit tak terhingga:
→ Jika bentuknya sudah pecahan: dibagi pangkat tertinggi
→ Jika bentuknya belum pecahan: dikali sekawan, baru dibagi pangkat tertinggi
Sifat operasi dengan ∞:

Contoh:

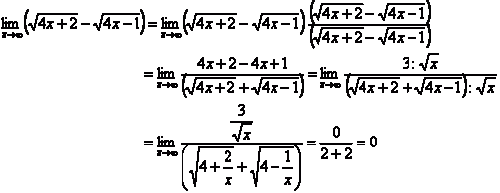
Cara cepat!
→ Untuk bentuk pecahan:
- Jika pangkat pembilang (atas) > penyebut (bawah), hasil =∞
- Jika pangkat pembilang (atas) < penyebut (bawah), hasil =0
- Jika pangkat pembilang (atas) = penyebut (bawah), hasil =koefisien pangkat tertinggi atas : koefisien pangkat tertinggi bawah
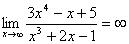
Contoh 2:

Contoh 3:
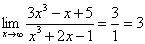
→ Untuk bentuk
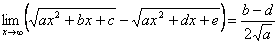
Contoh:
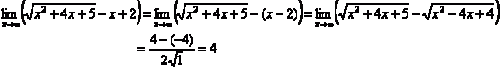
5. Limit trigonometri:

Untuk cosinus:
1 – cos ax = 2 sin2 ½ ax (dari rumus cos 2x)
cos ax – 1 = –2 sin2 ½ ax (dari rumus cos 2x)
1 – cos2ax = sin2ax (dari sin2x + cos2x = 1)
Bilangan e
Bilangan e didapat dari: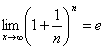
e = 2,718281828…
Rumus-rumus pengembangannya:

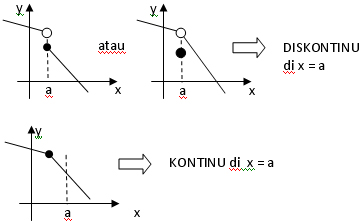
Kontinuitas
Suatu fungsi kontinu di x = a jika:1. f(a) ada (dapat dihitung/real)
2.
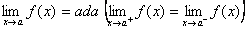
3.

Ilustrasi:

SEKIAN.